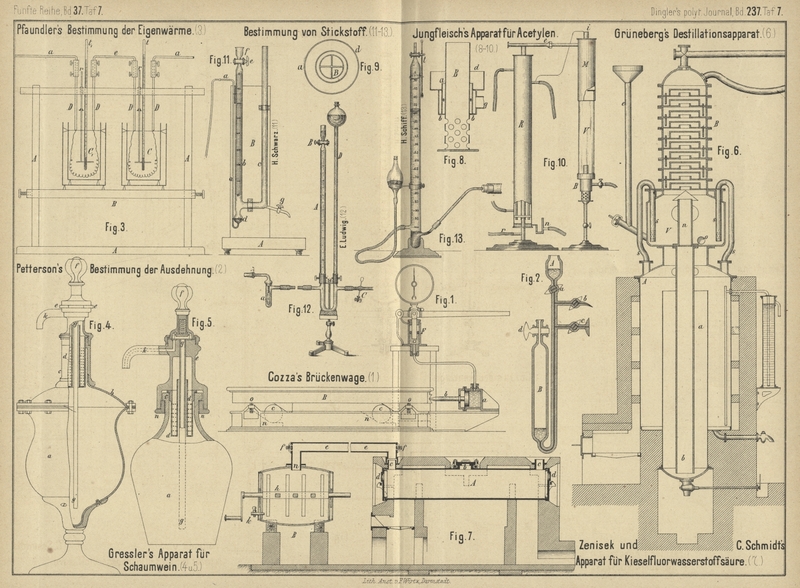
| Titel: | Bestimmung der Eigenwärme von Flüssigkeiten. |
| Fundstelle: | Band 237, Jahrgang 1880, S. 43 |
| Download: | XML |
Bestimmung der Eigenwärme von
Flüssigkeiten.
Mit einer Abbildung auf Tafel 7.
Pfaundler's Bestimmung der Eigenwärme von
Flüssigkeiten.
Zur Bestimmung der Wärmecapacität von Flüssigkeiten diente bisher fast immer die
Mischungsmethode. Man erhitzte entweder die zu untersuchende Flüssigkeit in einem
passenden Gefäſse auf eine bekannte Temperatur und tauchte dieselbe in das mit
Wasser gefüllte Calorimeter, oder man füllte die Flüssigkeit in das Calorimeter und
führte derselben eine bestimmbare Wärmemenge zu durch Eintauchen eines erhitzten
Körpers von bekannter specifischer Wärme. L. Pfaundler (Carl's Repertorium, 1880 S. 727) taucht nun in zwei
gleiche Calorimeter, die mit gleichen Gewichten verschiedener Flüssigkeiten gefüllt
sind, je eine Drahtspirale von gleichem Leitungswiderstände und leitet dann durch
beide denselben elektrischen Strom. Die dadurch hervorgebrachten Wärmemengen sind
dann gleich groſs und somit die Temperaturerhöhungen den Wärmecapacitäten umgekehrt
proportional.
Zur Ausführung des Versuches stehen auf dem in einem Gestelle A (Fig. 3 Taf.
7) senkrecht verschiebbaren Brettchen B die beiden
Calorimeter C und C1. Die beiden Thermometer t und t1
tauchen in die Flüssigkeiten, welche durch die kleinen Rührer r in Bewegung erhalten werden. Die dicken, durch ihre
Enden a mit einer Batterie, durch e mit einander verbundenen Zuleitungsdrähte D tauchen mit ihren zugespitzten Enden eben in die
Flüssigkeit. Sie tragen Spiralen aus gleichlangen Enden ein und desselben
Platindrahtes, deren ganz gleicher Widerstand geprüft ist.
Man senkt nun das Brettchen B, setzt
die Calorimeter nach einander auf die Wage, füllt sie, nahe zur gleichen Höhe, das
eine mit Wasser, das andere mit der zu untersuchenden Flüssigkeit und bestimmt die
Gewichtsmengen derselben. Hierauf stellt man die Calorimeter auf das Brettchen B und hebt dasselbe so weit, daſs die Enden der Drähte
D ein wenig eintauchen. Nun stellt man die nöthigen
Verbindungen her, läſst jedoch den Stromschlieſser noch offen. Die beiden Rührer
werden in Bewegung gesetzt und bis zum Ende des Versuches darin erhalten. Man
beginnt die gleichzeitigen Thermometerbeobachtungen, um die Wärmeverluste der beiden
Calorimeter bei ihren gegenwärtigen nicht zu sehr von einander verschiedenen
Temperaturen zu ermitteln. Man notirt nun bei offenem Schlieſsungskreise die
Temperaturen in gleichen Zeitabschnitten und schlieſst mit Ende eines solchen den
Strom. Nach ein paar Minuten ist die Temperatur um 4 bis 8° gestiegen, worauf der
Strom wieder mit Beginn
einer Zeiteinheit unterbrochen und die Thermometerstände noch einige Zeiteinheiten
hindurch notirt werden, um die Verluste der Calorimeter bei ihrer jetzigen
Temperatur bestimmen zu können. Die Lufttemperatur braucht nicht bemerkt zu werden.
Der ganze Versuch ist in einigen Minuten beendet. Will man ihn wiederholen, so
vertauscht man diesmal die Calorimeter sammt Flüssigkeiten und gleicht dadurch
etwaige Verschiedenheiten der Drähte und Thermometer aus.
Sieht man zur Berechnung der Versuche einstweilen von den Correctionen wegen der
Wärmeverluste der Calorimeter ab und bezeichnet man mit P1 das Gewicht des Wassers, mit W1 den Wasserwerth des
zugehörigen Calorimeters sammt Rührer, Thermometer und Spirale, mit ϑ1 dessen
Temperaturzunahme, ferner mit P, W und ϑ die gleichnamigen Werthe für die andere Flüssigkeit,
deren Wärmecapacität c bestimmt werden soll, so hat
man: (P_1+W_1)\,\vartheta_1=(Pc+W)\,\vartheta und daraus:
c=\frac{(P_1+W_1),\vartheta_1-W\,\vartheta}{P\,\vartheta}.
Zur Vermeidung der Ungenauigkeit, welche dadurch entsteht, daſs die Leitungsfähigkeit
des Platins sich mit der Temperatur ändert, bestimmt man die specifische Wärme der
zu untersuchenden Flüssigkeit zunächst annähernd und wählt dann ihre Gewichtsmengen
so groſs, daſs ihr Wasserwerth eben so viel beträgt, wie der des Wassers im anderen
Calorimeter, so daſs die Temperaturerhöhungen gleich groſs werden.
Tafeln